Westen Blot實驗的內(nèi)參選什么,看完就懂了!
發(fā)布日期:2025/2/7 16:23:07
Western Blot實驗常用于定性分析表達(dá)產(chǎn)物,以及檢測樣本中蛋白相對表達(dá)量。嚴(yán)謹(jǐn)?shù)腤estern Blot實驗設(shè)計中要求有良好的參照體系,包括分子量Marker,陽性參照蛋白以及內(nèi)參。內(nèi)參蛋白主要是一些管家基因,在多種組織和細(xì)胞中高水平表達(dá),且表達(dá)相對恒定。根據(jù)檢測樣本內(nèi)參的量,可以校正上樣誤差,使結(jié)果可信。
目前在實驗中比較常用的內(nèi)參基因主要為GAPDH(36KDa)、β-actin(42KDa)、β-tubulin(50-55KDa)。
(1)GAPDH(甘油醛-3-磷酸脫氫酶)GAPDH(甘油醛-3-磷酸脫氫酶)是在細(xì)胞代謝糖酵解中起關(guān)鍵作用的酶,由4個30-40kDa的亞基組成,檢測條帶大約在36kDa,通常表達(dá)量較高,在相同的細(xì)胞或組織中的表達(dá)量比較恒定。但是在缺氧和糖尿病等疾病情況中,GAPDH表達(dá)可能會發(fā)生變化,因此在這些情況下不推薦作為內(nèi)參。
(2)Actin(肌動蛋白)Actin是構(gòu)成細(xì)胞骨架的主要蛋白之一。最常用作內(nèi)參蛋白的是β-actin,檢測條帶大約在分子量42kDa。在許多真核細(xì)胞中都有廣泛且穩(wěn)定的表達(dá),適用于全細(xì)胞和細(xì)胞質(zhì)樣品。
(3)Tubulin(微管蛋白)Tubulin是構(gòu)成微管網(wǎng)絡(luò)的重要蛋白。最常用作內(nèi)參蛋白的是β-tubulin,檢測條帶大約在55 kDa。微管蛋白與維持細(xì)胞形態(tài)和分裂過程有關(guān),因此它的表達(dá)水平可能受細(xì)胞狀態(tài)變化的影響。抗生素和抗有絲分裂耐藥的細(xì)胞,Tubulin微管蛋白表達(dá)可能存在差異,即耐藥性研究可能不建議用Tubulin作為內(nèi)參蛋白。
(4)PCNA增殖細(xì)胞核抗原(Proliferating Cell Nuclear Antigen簡稱PCNA)由Miyachi等于1978年在 SLE(系統(tǒng)性紅斑狼瘡)患者的血清中首次發(fā)現(xiàn)并命名,因其只存在于正常增殖細(xì)胞及腫瘤細(xì)胞內(nèi)而得名。PCNA是一種分子量為36KD的蛋白質(zhì),在細(xì)胞核內(nèi)合成,并存在于細(xì)胞核內(nèi),為DNA聚合酶的輔助蛋白。由于其在細(xì)胞核內(nèi)穩(wěn)定表達(dá),因此其抗體被廣泛應(yīng)用于細(xì)胞核蛋白的內(nèi)參抗體。
在保證上樣量一致的情況下,相對于對照組,實驗組目的蛋白的表達(dá)水平是否有差異。挑選原則如下:
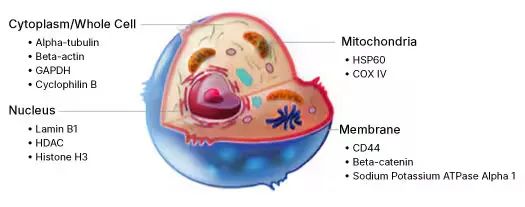
1、針對樣本而言首先考慮樣品的物種來源、目的蛋白的表達(dá)部位例如全細(xì)胞、細(xì)胞核、細(xì)胞質(zhì)、細(xì)胞膜或者血清 、血漿樣本等。
一般地,哺乳動物的細(xì)胞或者組織樣本選擇GAPDH、actin、tubulin(全細(xì)胞)、ATP1A1(細(xì)胞膜蛋白)、Histone H3(核蛋白)、Lamin(細(xì)胞核摸)、COX412(線粒體)、Albumin(全血、血漿、血清)作內(nèi)參。而一些稀有物種具體需要通過查閱文獻(xiàn)選擇比較保守的管家基因作為蛋白內(nèi)參。
2、蛋白分子量選擇
(1)原則上選擇的內(nèi)參與通常應(yīng)該保證目的蛋白與內(nèi)參蛋白分子量相差5 KDa以上例如PTEN(47-55KDa),此時內(nèi)參選擇GAPDH比較合適,NF-κb(65-70KDa),此時β-actin較合適,GAPDH也可以;另外若是分子量為42-45kDa,此時不適宜選擇β-actin 作為內(nèi)參,可以考慮選擇GAPDH或β-tubulin作為內(nèi)參。另外兩種內(nèi)參也是相同情況。
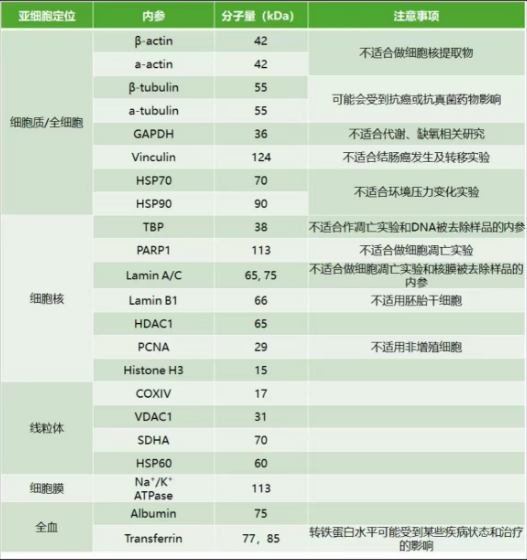
下圖不同內(nèi)參的分子量大小
(2)內(nèi)參和目的蛋白也不是相差越大越好
①轉(zhuǎn)膜時間不好控制,若內(nèi)參太小,目的蛋白太大,會導(dǎo)致內(nèi)參轉(zhuǎn)膜過度或者目的蛋白未完全轉(zhuǎn)上。此情況需要分開轉(zhuǎn)膜。
②保證穩(wěn)定性,內(nèi)參蛋白需要在不同樣本中穩(wěn)定表達(dá),以確保實驗結(jié)果的可靠性。如果內(nèi)參蛋白的表達(dá)水平與目的蛋白相差過大,可能會對目的蛋白的檢測產(chǎn)生干擾。
③另外若是同時處理多個樣本,將目的蛋白和內(nèi)參分開進(jìn)行檢測可以同時處理多個樣本,提高實驗效率。如果內(nèi)參和目的蛋白的表達(dá)水平相差過大,可能需要調(diào)整上樣量和抗體濃度,這可能會降低實驗效率。
3、細(xì)胞 、組織特異性在選擇內(nèi)參時,在考量實驗條件和研究背景下,不同的細(xì)胞類型和實驗?zāi)康目赡苄枰煌膬?nèi)參。
例如我們在做多細(xì)胞、多組織樣本或者動物實驗樣本對比表達(dá)量時,GAPDH作為內(nèi)參是比較合適,因為GAPDH作為細(xì)胞代謝過程中 關(guān)鍵酶類蛋白,在組織中表達(dá)比較恒定。而β-Actin和β-Tubulin是細(xì)胞骨架成分的 結(jié)構(gòu)蛋白,不同組織的細(xì)胞結(jié)構(gòu)會有差異性。
4、內(nèi)參帶條齊、目的蛋白有趨勢基本前提:
(1)內(nèi)參選擇正確(2)上樣量一致注意事項:目前我們在進(jìn)行Westen blot實驗室傾向于裁剪NC膜或者PVDF以減少整膜孵育抗體和洗膜的麻煩。根據(jù)經(jīng)驗來看,內(nèi)參抗體和目的蛋白抗體的蛋白分子量可能處于一個區(qū)間并不是一個準(zhǔn)確的位置,即存在理論位置和實際觀察位置 ,在閱讀抗體說明書時我們一般會使用抗體的實際觀察位置,否則就會因裁膜不當(dāng)造成條帶不全,或者條帶位置不正確。但是近些年許多雜志都要求整膜不允許裁膜,所以在裁膜孵育抗體必須考慮清楚。
目前在實驗中比較常用的內(nèi)參基因主要為GAPDH(36KDa)、β-actin(42KDa)、β-tubulin(50-55KDa)。
(1)GAPDH(甘油醛-3-磷酸脫氫酶)GAPDH(甘油醛-3-磷酸脫氫酶)是在細(xì)胞代謝糖酵解中起關(guān)鍵作用的酶,由4個30-40kDa的亞基組成,檢測條帶大約在36kDa,通常表達(dá)量較高,在相同的細(xì)胞或組織中的表達(dá)量比較恒定。但是在缺氧和糖尿病等疾病情況中,GAPDH表達(dá)可能會發(fā)生變化,因此在這些情況下不推薦作為內(nèi)參。
(2)Actin(肌動蛋白)Actin是構(gòu)成細(xì)胞骨架的主要蛋白之一。最常用作內(nèi)參蛋白的是β-actin,檢測條帶大約在分子量42kDa。在許多真核細(xì)胞中都有廣泛且穩(wěn)定的表達(dá),適用于全細(xì)胞和細(xì)胞質(zhì)樣品。
(3)Tubulin(微管蛋白)Tubulin是構(gòu)成微管網(wǎng)絡(luò)的重要蛋白。最常用作內(nèi)參蛋白的是β-tubulin,檢測條帶大約在55 kDa。微管蛋白與維持細(xì)胞形態(tài)和分裂過程有關(guān),因此它的表達(dá)水平可能受細(xì)胞狀態(tài)變化的影響。抗生素和抗有絲分裂耐藥的細(xì)胞,Tubulin微管蛋白表達(dá)可能存在差異,即耐藥性研究可能不建議用Tubulin作為內(nèi)參蛋白。
(4)PCNA增殖細(xì)胞核抗原(Proliferating Cell Nuclear Antigen簡稱PCNA)由Miyachi等于1978年在 SLE(系統(tǒng)性紅斑狼瘡)患者的血清中首次發(fā)現(xiàn)并命名,因其只存在于正常增殖細(xì)胞及腫瘤細(xì)胞內(nèi)而得名。PCNA是一種分子量為36KD的蛋白質(zhì),在細(xì)胞核內(nèi)合成,并存在于細(xì)胞核內(nèi),為DNA聚合酶的輔助蛋白。由于其在細(xì)胞核內(nèi)穩(wěn)定表達(dá),因此其抗體被廣泛應(yīng)用于細(xì)胞核蛋白的內(nèi)參抗體。
在保證上樣量一致的情況下,相對于對照組,實驗組目的蛋白的表達(dá)水平是否有差異。挑選原則如下:
1、針對樣本而言首先考慮樣品的物種來源、目的蛋白的表達(dá)部位例如全細(xì)胞、細(xì)胞核、細(xì)胞質(zhì)、細(xì)胞膜或者血清 、血漿樣本等。
一般地,哺乳動物的細(xì)胞或者組織樣本選擇GAPDH、actin、tubulin(全細(xì)胞)、ATP1A1(細(xì)胞膜蛋白)、Histone H3(核蛋白)、Lamin(細(xì)胞核摸)、COX412(線粒體)、Albumin(全血、血漿、血清)作內(nèi)參。而一些稀有物種具體需要通過查閱文獻(xiàn)選擇比較保守的管家基因作為蛋白內(nèi)參。

2、蛋白分子量選擇
(1)原則上選擇的內(nèi)參與通常應(yīng)該保證目的蛋白與內(nèi)參蛋白分子量相差5 KDa以上例如PTEN(47-55KDa),此時內(nèi)參選擇GAPDH比較合適,NF-κb(65-70KDa),此時β-actin較合適,GAPDH也可以;另外若是分子量為42-45kDa,此時不適宜選擇β-actin 作為內(nèi)參,可以考慮選擇GAPDH或β-tubulin作為內(nèi)參。另外兩種內(nèi)參也是相同情況。

下圖不同內(nèi)參的分子量大小
(2)內(nèi)參和目的蛋白也不是相差越大越好
①轉(zhuǎn)膜時間不好控制,若內(nèi)參太小,目的蛋白太大,會導(dǎo)致內(nèi)參轉(zhuǎn)膜過度或者目的蛋白未完全轉(zhuǎn)上。此情況需要分開轉(zhuǎn)膜。
②保證穩(wěn)定性,內(nèi)參蛋白需要在不同樣本中穩(wěn)定表達(dá),以確保實驗結(jié)果的可靠性。如果內(nèi)參蛋白的表達(dá)水平與目的蛋白相差過大,可能會對目的蛋白的檢測產(chǎn)生干擾。
③另外若是同時處理多個樣本,將目的蛋白和內(nèi)參分開進(jìn)行檢測可以同時處理多個樣本,提高實驗效率。如果內(nèi)參和目的蛋白的表達(dá)水平相差過大,可能需要調(diào)整上樣量和抗體濃度,這可能會降低實驗效率。
3、細(xì)胞 、組織特異性在選擇內(nèi)參時,在考量實驗條件和研究背景下,不同的細(xì)胞類型和實驗?zāi)康目赡苄枰煌膬?nèi)參。
例如我們在做多細(xì)胞、多組織樣本或者動物實驗樣本對比表達(dá)量時,GAPDH作為內(nèi)參是比較合適,因為GAPDH作為細(xì)胞代謝過程中 關(guān)鍵酶類蛋白,在組織中表達(dá)比較恒定。而β-Actin和β-Tubulin是細(xì)胞骨架成分的 結(jié)構(gòu)蛋白,不同組織的細(xì)胞結(jié)構(gòu)會有差異性。
4、內(nèi)參帶條齊、目的蛋白有趨勢基本前提:
(1)內(nèi)參選擇正確(2)上樣量一致注意事項:目前我們在進(jìn)行Westen blot實驗室傾向于裁剪NC膜或者PVDF以減少整膜孵育抗體和洗膜的麻煩。根據(jù)經(jīng)驗來看,內(nèi)參抗體和目的蛋白抗體的蛋白分子量可能處于一個區(qū)間并不是一個準(zhǔn)確的位置,即存在理論位置和實際觀察位置 ,在閱讀抗體說明書時我們一般會使用抗體的實際觀察位置,否則就會因裁膜不當(dāng)造成條帶不全,或者條帶位置不正確。但是近些年許多雜志都要求整膜不允許裁膜,所以在裁膜孵育抗體必須考慮清楚。
.jpg)
