
細菌死活染色試劑盒(DMAO/PI)
| 英文名 | DMAO/PI Live/Dead Bacterial Double Stain Kit | ||
| 產品編號 | FS4006 | ||
| 產品分類 | 微生物培養(yǎng)基 | ||
| 純度 | N/A | 儲存條件 | -20℃ |
產品簡介
DMAO,即N, N-dimethylaniline N-oxide,是一種核酸綠色熒光染料,對于革蘭氏陽性和陰性細菌均適用,且既能染色活細菌,也能染色死細菌。該染料具有膜通透性,能透過細胞膜,優(yōu)先結合雙鏈DNA。DMAO非常穩(wěn)定,在室溫下進行常規(guī)操作和保存不易降解。PI是一種非滲透性熒光染料,不能穿過具有生物活性的細胞質膜,因此對于具有完整細胞膜的細菌不能染色。而對于壞死細菌,其細胞膜的完整性喪失,PI可進入細胞核并與雙鏈DNA結合,并嵌入細菌的DNA雙螺旋形成PI-DNA復合物從而產生紅色熒光,這種結合很少或幾乎沒有序列偏好,每4-5個堿基對插入一分子PI染料。將DMAO與PI聯(lián)合使用檢測細菌的死活,具有完整細胞膜的活細菌呈現(xiàn)綠色熒光,細胞膜受損的死細菌同時呈現(xiàn)綠色與紅色熒光。
DMAO-DNA復合物的最大激發(fā)光波長為503nm,最大發(fā)射光波長為530nm;PI-DNA復合物的最大激發(fā)光波長為535nm,最大發(fā)射光波長為617nm。DMAO-DNA和PI-DNA的激發(fā)光譜和發(fā)射光譜參考圖1,可分別使用FITC和Cy3通道觀察。
本品中文名稱細菌死活染色試劑盒(DMAO/PI),英文名稱LIVE/DEAD Bacterial Staining Kit with DMAO & PI,或LIVE/DEAD Bacterial Viability Kit with DMAO and PI,也稱細菌活力檢測試劑盒(Bacterial Viability Assay Kit)或細菌毒性檢測試劑盒(Bacterial Cytotoxicity Assay Kit),是一種高效、便捷、靈敏的基于DNA綠色熒光染料DMAO和紅色熒光染料碘化丙啶(Propidium iodide, PI)的雙熒光染色法檢測細菌死活的試劑盒。本試劑盒檢測時,活細菌呈現(xiàn)綠色熒光,死細菌呈現(xiàn)綠色和紅色兩種熒光。本試劑盒可使用熒光顯微鏡、激光共聚焦顯微鏡、熒光酶標儀、流式細胞儀等熒光檢測系統(tǒng)進行檢測。
本試劑盒提供的DMAO與PI均為1000×的儲存液,溶液經過優(yōu)化,對大多數(shù)細菌都適用,但為了獲得更滿意的結果,對于不同類型的細菌請自行進行一定的濃度摸索,DMAO和PI的使用終濃度一般為0.5-2×,最優(yōu)先的推薦終濃度為1×。同時,本試劑盒提供檢測緩沖液,該緩沖液可用于細菌死活染色工作液的配制。
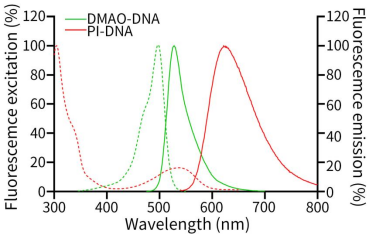
圖1.DMAO-DNA和PI-DNA的激發(fā)光譜和發(fā)射光譜。
產品組成
|
編號 組分 |
FS4006-活細菌/死細菌雙染試劑盒(DMAO/PI) (DMAO /PI Live/Dead Bacterial Double Stain Kit) |
規(guī)格 |
規(guī)格 |
規(guī)格 |
保存方法 |
|
200T |
500T |
1000T |
|||
|
FS4006-A |
DMAO Solution (1000×) |
20μl |
50ul |
100ul |
-20ºC避光 |
|
FS4006-B |
PI Solution(1000×) |
20μl |
50ul |
100ul |
-20ºC避光 |
|
FS4006-C |
檢測緩沖液 |
1ml |
5ml |
10ml |
-20ºC保存 |
保存與運輸方法:-20℃避光保存,有效期一年。 冰袋運輸。
使用方法(以下步驟僅用作示例以指導科研人員開展自身細菌樣本的染色。)
一、培養(yǎng)條件和細菌懸液的制備
【注意】:用本試劑盒進行細菌染色,務必要小心去除培養(yǎng)基殘留,因為,核酸和其它培養(yǎng)基成分可能以不可預料的方式與DMAO和PI結合,導致染色結果發(fā)生不可接受的變動。簡單的一次清洗步驟通常足以去除培養(yǎng)基內含的培養(yǎng)基成分干擾物殘留。不建議使用磷酸鹽清洗緩沖液,因此可能降低染色效率。
1.1 用營養(yǎng)肉湯培養(yǎng)大腸桿菌或金黃色葡萄球菌(30ml)使其生長至對數(shù)生長后期。
1.2 于10000×g離心10-15min,濃縮25ml細菌培養(yǎng)物。
1.3 吸走上清液,用2ml 0.85% NaCl或適當緩沖液來重懸沉淀。
1.4 取1ml重懸菌液分別加入含20ml 0.85% NaCl或適當緩沖液的30-40ml離心管(設置為活細菌組),用含20ml 70%異丙醇(也可以用其他方法比如高熱處理殺死細菌)的30-40ml離心管(設置為死細菌組)。
1.5 兩管樣品(分別為活細菌組和死細菌組)于室溫孵育1h,每隔15min顛倒混勻一次。
1.6 兩管樣品(分別為活細菌組和死細菌組)于10000×g離心10-15min。
1.7 用20ml 0.85% NaCl或適當緩沖液重懸沉淀,并且按照步驟1.6再離心一次。
1.8 分別用10ml 0.85% NaCl或適當緩沖液重懸兩管樣品。
1.9 分別取3ml菌液測定670nm的光密度(OD670),用玻璃或丙烯酸酯比色皿(1cm路徑)。
1.10 對于大腸桿菌或金黃色葡萄球菌的建議染色濃度,根據(jù)你的儀器類型(熒光顯微鏡、熒光光度經、熒光酶標儀)或流式細胞儀來參考相應部分的染色條件。
二、熒光顯微鏡操作步驟
2.1活菌和死菌的熒光可能用標準的熒光素長通濾片設置來同時觀察。替代方案的話,活菌(綠色熒光)和死菌(紅色熒光)可分別用雙通道:熒光素FITC和Texas Red帶通濾光片設置。用于本試劑盒檢測的建議熒光顯微鏡濾片設置見表1。
表1 適用于本試劑盒檢測用的常見濾光片特征
|
Omega濾光片* |
Chroma濾光片* |
注意事項 |
|
XF25, XF26, XF115 |
11001, 41012, 71010 |
用于同時觀察DMAO和PI染色的長通和雙發(fā)射濾光片 |
|
XF22, XF23 |
31001, 41001 |
僅用于觀察DMAO的帶通濾光片 |
|
XF32, XF43, XF102, XF108 |
31002, 31004, 41002, 4100 |
僅用于觀察PI的帶通濾光片 |
|
用于熒光顯微鏡觀察的推薦帶通濾光片。Omega濾光片由Omega Optical提供,Chroma濾光片由Chroma Technolog公司提供。 |
||
油鏡100×計數(shù)>5個視野,計算存活率:存活率(%)=綠色熒光細胞數(shù)/(綠色+紅色光細胞數(shù))×100
三、流式細胞儀操作步驟
儀器的檢測配置可能要因實際情況來調整,但此處列出的檢測技術和設置參數(shù)適用于市場上絕大多數(shù)流式細胞儀。
FL1通道: (530/30nm) DMAO (檢測活菌)
FL3通道: (>670nm) PI (檢測死菌)
閾值設定:排除粒徑<0.2um碎片(避免假陽性)
結果判斷與數(shù)據(jù)驗證分析
|
表型
|
DMAO信號 |
PI信號 |
生理狀態(tài)判定 |
|
健康活菌 |
+++ |
- |
代謝活躍,膜完整 |
|
早期凋亡菌 |
++ |
+ |
膜輕微損傷,酶活性存留 |
|
死菌 |
- |
+++ |
膜崩解,DNA暴露 |
|
VBNC(活不可培) |
+ |
- |
休眠態(tài),需結合ATP檢測確認 |
注意事項
1) 由于試劑盒內DMAO和PI的組分量少,室溫回溫充分融化后,務必低速離心沉至管底后再開蓋。
2) 兩款探針溶液本身就是溶于DMSO中,所以后續(xù)無需再單獨添加,第一次使用可將DMAO和PI根據(jù)單次用量分裝保存,密封后置于≤-20℃避光保存。
3) 組分C檢測緩沖液經過過濾除菌處理,在使用時須注意避免微生物污染,否則很可能嚴重影響染色效果。如果檢測緩沖液發(fā)生渾濁等明顯的微生物污染,就不能繼續(xù)使用。
4) DMAO 和PI結合核酸,PI是潛在的誘變劑,目前沒有數(shù)據(jù)闡明DMAO的誘變性或毒性,兩種試劑使用都需做恰當防護。DMSO能促進有機分子進入組織。強烈建議處理DMSO儲存液時戴雙層手套。對于核酸染料,含此類染料的試劑經活性炭吸附后再進行廢液處理。活性炭之后經焚燒來破壞染料。
5) 為了您的安全和健康,請穿實驗服并戴一次性手套操作。
常見問題及解決方案
|
問題現(xiàn)象 |
原因分析 |
優(yōu)化解決方案 |
|
背景熒光高 |
染料殘留或菌體自熒光 |
增加緩沖液洗滌次數(shù)(≥3次),增加0.1%BSA阻斷 |
|
革蘭氏陽性菌染色弱 |
細胞壁阻擋PI滲透 |
預冷甲醇固定5 min或使用通透增強劑0.1%Triton X-100 |
|
熒光信號淬滅快 |
光照過度或氧化損傷 |
|
|
假陽性死菌 |
離心力過大導致機械損傷 |
離心力降至5000g以下,改用濾膜濃縮法 |
相關產品
|
貨號 |
名稱 |
規(guī)格 |
|
20µl |
||
|
50µl |
||
|
10mg |
||
|
10mg |
||
|
5mg |
||
|
Live/Dead Bacterial Double Stain Kit 活細菌/死細菌雙染試劑盒(SYTO 9/PI ) |
40T |
|
|
200T |
.jpg)
